Биосинтез доксорубицина - Biosynthesis of doxorubicin
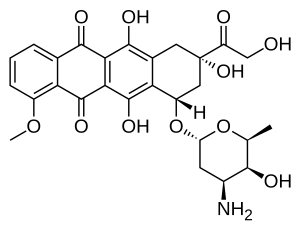
Доксорубицин (DXR) - это 14-гидроксилированный версия даунорубицин, непосредственный предшественник DXR в его биосинтетический путь. Даунорубицин более широко встречается как натуральный продукт потому что его производят различные дикого типа напряжения из стрептомицеты. Напротив, только один известный не-дикого типа разновидность, стрептомицеты Peucetius подвид цезий Первоначально было обнаружено, что ATCC 27952 способен продуцировать более широко используемый доксорубицин.[1] Этот штамм был создан Arcamone et al. в 1969 г. мутирующий а напряжение производит даунорубицин, но не DXR, по крайней мере, в определяемых количествах.[2] Впоследствии группа Хатчинсона показала, что в особых условиях окружающей среды или путем введения генетические модификации, другие штаммы стрептомицеты может производить доксорубицин.[3] Его группа также клонированный многие из гены необходимы для производства DXR, хотя не все из них полностью охарактеризованы. В 1996 году группа Штроля обнаружила, изолировала и охарактеризовала dox A, ген кодирование фермент который превращает даунорубицин в DXR.[4] К 1999 году они получили рекомбинантный Dox A, a Цитохром Р450 оксидаза, и обнаружил, что это катализирует несколько шагов в DXR биосинтез, включая шаги, ведущие к даунорубицину.[5] Это было важно, поскольку стало ясно, что все штаммы, продуцирующие даунорубицин, имеют необходимые гены для производства DXR, гораздо более терапевтически важного из двух. Группа Хатчинсона продолжила разработку методов увеличения выхода DXR из ферментация процесс, используемый в его коммерческом производстве, не только путем введения кодировки Dox A плазмиды, но также путем введения мутаций для деактивации ферменты которые шунтируют предшественники DXR в менее полезные продукты, например, подобные баумицину гликозиды.[1] Некоторые тройные мутанты, которые тоже чрезмерно выраженный Докса А смогли удвоить выход DXR. Это представляет более чем академический интерес, поскольку в то время DXR стоил около 1,37 миллиона долларов за кг, а текущее производство в 1999 году составляло 225 кг в год.[6] Более эффективные методы производства снизили цену до 1,1 миллиона долларов за кг для нелипосомальный формулировка. Хотя DXR можно производить полусинтетически из даунорубицина процесс включает электрофильный бромирование и несколько шагов, и урожай плохой.[7] Поскольку даунорубицин производится ферментация, было бы идеально, если бы бактерии может завершить синтез DXR более эффективно.
Обзор
В антрациклин скелет доксорубицина (DXR) производится Поликетидсинтаза II типа (PKS) в Streptomyces peucetius. Сначала 21-углеродная декакетидная цепь (рис. 1. (1)) синтезируется из одной 3-углеродной пропионильной группы из пропионил-КоА, и 9 2-углеродных единиц, полученных из 9 последовательных (итеративный ) декарбоксилатный конденсаты из малонил-КоА. Каждый малонил-КоА единица вносит 2-углеродный кетидный блок в растущую цепь поликетида. Каждое добавление катализируется "минимальным ПКС", состоящим из белок-носитель ацила (ACP), а кетосинтаза (KS) / коэффициент длины цепи (CLF) гетеродимер и малонил-Коа: АСР-ацилтрансфераза (МАТ). (См. верхнюю часть рисунка 10.
Этот процесс очень похож на синтез жирных кислот, к синтазы жирных кислот и к типу I поликетидный синтез. Но, в отличие от жирная кислота синтез, кето группы растущей поликетидной цепи не модифицируются во время удлинения цепи и обычно не полностью уменьшенный. В отличие от систем PKS типа I, синтетические ферменты (KS, CLF, ACP и AT) не прикрепляются ковалентно друг с другом, и могут даже не оставаться связанными на каждой стадии синтеза поликетидной цепи.
После того, как 21-углеродная декакетидная цепь DXR завершается, производятся последовательные модификации, чтобы в конечном итоге произвести тетрациклический антрациклин агликон (без гликозид прикрепил).[8] В даунозамин аминосахар, активируется добавлением Дифосфат тиамина TDP, создается в другой серии реакций.[9] Он присоединяется к антрациклин агликон и дальнейшие модификации производятся для получения первого даунорубицин затем DXR.[10]Есть как минимум 3 кластеры генов важно для DXR биосинтез: dps гены которые определяют ферменты необходимый для синтеза линейной поликетидной цепи и ее первых циклизаций, кластер dnr отвечает за оставшиеся модификации антрациклин структура и гены dnm, участвующие в аминосахар, даунозамин, синтез. Дополнительно есть набор «Самостойкость». гены для снижения токсического воздействия антрациклин на производстве организм. Один механизм - это мембрана насос, который вызывает излияние DXR вне клетки (drr места ).[11] Поскольку эти сложные молекулы полезны только в определенных условиях и требуют большого количества энергии для производства, их синтез жестко регулируется.[12]
Синтез поликетидных цепей
Доксорубицин синтезируется специализированным поликетидсинтаза.
Исходным событием в синтезе DXR является выбор пропионил-КоА стартер и его декарбоксилатный в дополнение к двум углеродным кетидным единицам, полученным из малонил-КоА для производства пятиуглеродистого B-кетовалерил ACP. Пятиуглеродный дикетид доставляется ACP к цистеин сульфгидрил группы на активном сайте КС, по тиоэфир обмена, и ACP освобождается из цепочки. Бесплатная ACP подбирает другую малонатный группа из малонил-КоА, также тиоэфир обмен, с выпуском CoA.

ACP приносит новые малонатный на активный сайт КС где это декарбоксилированный, возможно, с помощью CLF подразделение, и соединились, чтобы произвести 7-углеродный трикетид, теперь прикрепленный к ACP (см. верхнюю часть рисунка 1). Снова ACP передает цепочку субъединице KS, и процесс повторяется итеративно до тех пор, пока decaketide не завершится.
В большинстве систем типа II исходным событием является доставка ACP ацетат единица, полученная из ацетил-КоА, в активный сайт кетосинтазы (KS) подразделение гетеродимера KS / CLF. Режим по умолчанию для систем PKS типа II - это включение ацетата в качестве праймера, и это справедливо для DXR «минимальный PKS». Другими словами, действие KS / CLF / ACP (Dps A, B и G) из этой системы не вызовет 21-углерод декаетиды, но вместо этого декаетиды с 20 атомами углерода, потому что ацетат является «предпочтительным» стартером. Процесс определения пропионат не полностью изучен, но ясно, что это зависит от дополнительного белка, Dps C, который может действовать как кетосинтаза или ацилтрансфераза, селективный для пропионил-КоА, и, возможно, Dps D вносит свой вклад.[13][14]
Было обнаружено, что специальный MAT незаменим для производства поликетидов в условиях in vitro.[15] ПКС может «одолжить» ВСУ у своего собственного синтаза жирных кислот и это может быть основным способом получения ACP малонатная группа в биосинтезе DXR. Кроме того, есть отличные доказательства [16] что «самомалонилирование» является неотъемлемой характеристикой ACP типа II. Таким образом, данный PKS типа II может предоставлять свои собственные MAT, он может заимствовать один из FAS или его ACP может «самомалонилатировать».
Неизвестно, сопровождает ли один и тот же тройной комплекс KS / CLF / ACP рост полноразмерной поликетидной цепи на протяжении всего каталитического цикла, или же ACP диссоциирует после каждой реакции конденсации.[17] А 2.0-Å Структура разрешения актинородина KS / CLF, которая очень похожа на dps KS / CLF, показывает, что поликетиды вытянуты внутри амфипатический туннель, сформированный на стыке субъединиц KS и CLF.[18] Туннель около 17-Å длинный и одна сторона имеет много заряженных аминокислотные остатки которые, кажется, стабилизируют карбонил группы цепи, а другая сторона гидрофобный. Эта структура объясняет, почему обе субъединицы необходимы для удлинения цепи и как реактивно растущая цепь защищена от случайного спонтанный реакции до тех пор, пока он не будет правильно расположен для упорядоченной циклизации. Структура также предполагает механизм регулирования длины цепи. Аминокислота боковые группы заходят в туннель и действуют как «ворота». Несколько особенно объемных остатков могут быть непроходимыми для цепи, вызывая обрыв. Модификации туннельных остатков на основе этой структуры смогли изменить длину цепи конечного продукта.[19] Финал конденсация заставляет поликетидную цепь "изгибаться", позволяя внутримолекулярный атака C-12 метилен карбанион, создано фермент катализированный протон удаление и стабилизация электростатический взаимодействия в туннеле, на С-7 карбонил (см. 3 на рисунке 1). Этот туннель способствовал внутримолекулярной альдольная конденсация обеспечивает первую циклизацию, когда цепь все еще находится в туннеле. Такая же атака C-7 / C-12 происходит в биосинтез DXR аналогичным образом.
Превращение в 12-дезоксиалкалоновую кислоту
Декакетид из 21 углерода превращается в 12-дезоксиалкалоновую кислоту (5), первое свободное легко выделяемое промежуточное соединение в биосинтезе DXR, в 3 этапа. Эти шаги катализируются последними 3 ферментами в dps кластер генов и считаются частью поликетидсинтаза.
В то время как декаетид все еще связан с гетероциклической группой KS / CLF.димер 9-карбонил группа восстанавливается Dps E, 9-кеторедуктазой, используя НАДФН как Восстановитель /гидрид донор. Dps F, «1-е кольцо» циклаза ”/ Ароматаза, очень специфична и относится к семейству циклаз C-7 / C-12, которые требуют предварительного кето-восстановления C-9.[20] Считается, что эти две реакции происходят, пока поликетидная цепь все еще частично находится в туннеле KS / CLF, и неизвестно, что в конечном итоге отщепляет цепь от ковалентного звена до KS или ACP. Если Dps F циклаза инактивирован мутации или же делеции генов, цепь будет циклизоваться спонтанно в случайный мода. Таким образом, считается, что Dps F «шаперон» или помогает сворачивать поликетид для обеспечения неслучайной циклизации, реакции, которая является энергетически выгодной и приводит к последующим обезвоживание и в результате ароматизация.[21]
Далее, Dps Y региоселективно способствует формированию следующих двух углерод-углеродные связи а затем катализирует обезвоживание ведущий к ароматизация одного из колец дать (5).
Преобразование в ε-родомицинон
Следующие реакции катализируются ферментами, происходящими из ДНК. кластер генов. Днр Г, а С-12 оксигеназа (о нумерации см. (5)) вводит кето группа с помощью молекулярный кислород. Это "антрон тип оксигеназа ", также называемый хинон -образующие монооксигеназы, многие из которых имеют важное значение ферменты ' в биосинтез нескольких видов ароматный поликетид антибиотики. У них нет кофакторы: нет флавины, металлы или источники энергии. Их механизм плохо понимается, но может включать "белок радикальный ".[22]
Алкалоновая кислота (6), а хинон, это товар. Dnr C, щелочная кислота-O-метилтрансфераза метилаты то карбоновая кислота конец молекула формирование сложный эфир, с помощью S-аденозил метионин (SAM) как кофактор /метильная группа донор. Продукт представляет собой метиловый эфир щелочной кислоты (7). В метильная группа удаляется позже, но он служит для активации соседнего метиленового мостика, облегчая его атаку на терминал карбонил группа, реакция, катализируемая DnrD.
Dnr D, циклаза четвертого кольца (AAME-циклаза), катализирует внутримолекулярный добавление альдола реакция. Никаких кофакторов не требуется, ни ароматизация, ни дегидратация не происходит. Простой основание предложен каталитический механизм.[23] Продукт - аклавикетон (8).
Dnr H, аклавикетон редуктаза, стереоспецифично восстанавливает 17-кетогруппу нового четвертого кольца до 17-ОН с образованием аклавинона (9). Это вводит новый хиральный центр и НАДФН является кофактором.
Dnr F, аклавинон-11-гидроксилаза, это ФАД монооксигеназа который использует НАДФН активировать молекулярный кислород для последующих гидроксилирование. ε-родомицинон (10) является продуктом.[24]
Превращение в доксорубицин
Днр С, даунозамин гликозилтрансфераза катализирует добавление TDP активировано гликозид, L-даунозамин -TDP на ε-родомицинон с образованием родомицина D (рис. 2). Выпуск TDP стимулирует реакцию. Фермент имеет сходство последовательностей к гликозилтрансферазам других «необычных сахаров», добавленных к PKS типа II ароматный товары.[25]

Dnr P, родомицин D метилэстераза, удаляет метильная группа добавлен ранее DnrC. Первоначально он служил для активации соседнего метиленового мостика, а затем предотвращал его карбоксил группа от выхода углерода C-10 (см. фиг. 2). Имел карбоксил группа не была этерифицированный перед циклизацией четвертого кольца его исход как [ СО2 было бы благоприятно для формирования бициклический ароматный система. После сокращения C-7 и гликозилирование, метиленовый мостик C-8 больше не активируется для депротонирование, тем самым снижая вероятность ароматизации.[23] Обратите внимание, что неизолированные средний с нумерацией - это третья молекула на рис. 2. Система нумерации очень странная и является следом ранней номенклатуры. В декарбоксилирование из средний происходит самопроизвольно или под действием Dnr P, давая 13-дезоксикарминомицин.
А Кристальная структура со связанными продуктами аклациномицина метиловогоэстераза, [фермент] с 53% гомология последовательностей до Днр П, от стрептомицеты Purpurascens, было решено.[26] Он способен катализировать ту же реакцию и использует классический Сер -Его -Жерех каталитическая триада с серин действуя как нуклеофил и гли -встретились обеспечение стабилизации переходное состояние путем формирования "оксианионная дыра ". активный сайт аминокислоты почти полностью такие же, как Dnr P, и механизм почти наверняка идентичен. Хотя Dox A показан следующим на схеме биосинтеза (Рисунок 2), Dnr K, карминомицин 4-O-метилтрансфераза умеет O-метилат 4-гидроксил группа любого из гликозиды на рисунке 2. Разрешение 2,35 Å. Кристальная структура из фермент со связанными продуктами недавно была решена.[27] Ориентация продуктов соответствует Механизм SN2 переноса метила. Сайт-направленный мутагенез потенциальной кислоты / основания остатки в активный сайт не повлиял катализ что приводит к выводу, что Dnr K, скорее всего, действует как энтропийный фермент в этом повышение скорости в основном связано с эффектами ориентации и близости. Это контрастирует с большинством других О-метилтрансфераз, где кислотно-основной катализ, как было продемонстрировано, вносит существенный вклад в повышение скорости. Dox A катализирует три последовательных окисления в стрептомицеты Peucetius. Недостаточное производство DXR в первую очередь связано не с низким уровнем или неисправностью Dox A, а с тем, что существует множество продуктов, отклоненных от пути, показанного на рисунке 2. Каждый из гликозиды является потенциальной мишенью для шунтирующих ферментов (не показано), некоторые из которых являются продуктами ДНК кластер генов. Мутации из этих ферментов значительно увеличивает производство DXR.[1] Кроме того, Dox A имеет очень низкий тыс. кат. / км значение для C-14 окисление (130 / M) по сравнению с окислением C-13 (до 22000 / M для некоторых подложек). Генетические манипуляции с сверхэкспрессировать Dox A также увеличивает урожайность, особенно если гены шунтирующих ферментов инактивированы одновременно. монооксигеназа цитохрома Р-450 который имеет широкий субстратная специфичность, катализирующий антрациклин гидроксилирование в C-13 и C-14 (Рисунок 2). В фермент имеет абсолютную потребность в молекулярный кислород и НАДФН.[5] Первоначально проводят два последовательных окисления на C-13, за которыми следует однократное окисление C-14, которое превращает даунорубицин к доксорубицину.
Рекомендации
- ^ а б c Ломовская Н., Оттен С.Л., Дой-Катаяма Ю. и др. (1999). «Избыточное производство доксорубицина в Streptomyces peucetius: клонирование и характеристика генов dnrU кеторедуктазы и dnrV и гена гидроксилазы doxA цитохрома P-450». J. Bacteriol. 181 (1): 305–18. Дои:10.1128 / JB.181.1.305-318.1999. ЧВК 103563. PMID 9864344.
- ^ Аркамоне Ф., Кассинелли Дж., Фантини Дж. И др. (1969). «Адриамицин, 14-гидроксидауномицин, новый противоопухолевый антибиотик из S. peucetius var. Caesius». Biotechnol. Bioeng. 11 (6): 1101–10. Дои:10.1002 / бит. 260110607. PMID 5365804.
- ^ Гримм А., Маддури К., Али А., Хатчинсон CR (1994). «Характеристика генов Streptomyces peucetius ATCC 29050, кодирующих доксорубицин-поликетидсинтазу». Ген. 151 (1–2): 1–10. Дои:10.1016/0378-1119(94)90625-4. PMID 7828855.
- ^ Диккенс ML, Штрол WR (1996). «Выделение и характеристика гена из штамма C5 Streptomyces sp., Который придает способность превращать дауномицин в доксорубицин Streptomyces lividans TK24». J. Bacteriol. 178 (11): 3389–95. Дои:10.1128 / jb.178.11.3389-3395.1996. ЧВК 178102. PMID 8655530.
- ^ а б Вальчак Р.Дж., Диккенс М.Л., Пристли Н.Д., Штрол В.Р. (1999). «Очистка, свойства и характеристика рекомбинантного штамма Streptomyces sp. C5 DoxA, цитохрома P-450, катализирующего несколько этапов биосинтеза доксорубицина». J. Bacteriol. 181 (1): 298–304. Дои:10.1128 / JB.181.1.298-304.1999. ЧВК 103562. PMID 9864343.
- ^ Хатчинсон CR, Коломбо AL (1999). «Генная инженерия производства доксорубицина в Streptomyces peucetius: обзор». J. Ind. Microbiol. Биотехнология. 23 (1): 647–52. Дои:10.1038 / sj.jim.2900673. PMID 10455495.
- ^ Лаун Дж. В. (1993). «Антрациклиновые и антрахиноновые противораковые агенты: текущее состояние и последние разработки». Pharmacol. Ther. 60 (2): 185–214. Дои:10.1016 / 0163-7258 (93) 90006-У. PMID 8022857.
- ^ Хатчинсон CR (1997). «Биосинтетические исследования даунорубицина и тетраценомицина C». Химические обзоры. 97 (7): 2525–2536. Дои:10.1021 / cr960022x. PMID 11851469.
- ^ Оттен С.Л., Галло М.А., Маддури К., Лю X, Хатчинсон CR (1997). «Клонирование и характеристика генов Streptomyces peucetius dnmZUV, кодирующих три фермента, необходимых для биосинтеза предшественника даунорубицина тимидиндифосфо-L-даунозамина». J. Bacteriol. 179 (13): 4446–50. ЧВК 179277. PMID 9209071.
- ^ Диккенс М.Л., Пристли Н.Д., Штрол В.Р. (1997). «Биоконверсия эпсилон-родомицинонового гликозида в доксорубицин in vivo и in vitro: функции DauP, DauK и DoxA». J. Bacteriol. 179 (8): 2641–50. ЧВК 179014. PMID 9098063.
- ^ Гандлур С.М., Вей Л., Левин Дж., Рассел Дж., Каур П. (2004). «Мембранная топология белка DrrB транспортера доксорубицина Streptomyces peucetius». J. Biol. Chem. 279 (26): 27799–806. Дои:10.1074 / jbc.M402898200. PMID 15090538.
- ^ Цзян Х., Хатчинсон CR (2006). «Обратная связь регуляции биосинтеза доксорубицина у Streptomyces peucetius». Res. Микробиол. 157 (7): 666–74. Дои:10.1016 / j.resmic.2006.02.004. PMID 16545946.
- ^ Бао В., Шелдон П.Дж., Хатчинсон К.Р. (1999). «Очистка и свойства Streptomyces peucetius DpsC бета-кетоацил: ацил-носитель белка-синтазы III, который определяет звено-инициатор пропионата для биосинтеза поликетида типа II». Биохимия. 38 (30): 9752–7. Дои:10.1021 / bi990751h. PMID 10423255.
- ^ Бао В., Шелдон П.Дж., Вендт-Пиенковски Э., Хатчинсон С.Р. (1999). «Ген Streptomyces peucetius dpsC определяет выбор стартовой единицы в биосинтезе поликетида даунорубицина». J. Bacteriol. 181 (15): 4690–5. ЧВК 103607. PMID 10419974.
- ^ Матару А.Л., Кокс Р.Дж., Кросби Дж., Байром К.Дж., Симпсон Т.Дж. (1998). «MCAT не требуется для синтеза поликетидов in vitro в минимальной поликетидсинтазе актинородина из Streptomyces coelicolor». Chem. Биол. 5 (12): 699–711. Дои:10.1016 / S1074-5521 (98) 90663-9. PMID 9862793.
- ^ Артур CJ, Szafranska A, Evans SE и др. (2005). «Самомалонилирование является внутренним свойством химически синтезированного белка-носителя ацила поликетидсинтазы типа II». Биохимия. 44 (46): 15414–21. Дои:10.1021 / bi051499i. PMID 16285746.
- ^ Драйер Дж, Хосла С. (2000). «Механистический анализ поликетидсинтазы типа II. Роль консервативных остатков в гетеродимере фактора длины цепи бета-кетоацилсинтазы». Биохимия. 39 (8): 2088–95. Дои:10.1021 / bi992121l. PMID 10684659.
- ^ Китинг-Клей А.Т., Малтби Д.А., Медзихрадски К.Ф., Хосла С., Страуд Р.М. (2004). «Завод антибиотиков заработал». Nat. Struct. Мол. Биол. 11 (9): 888–93. Дои:10.1038 / nsmb808. PMID 15286722.
- ^ Тан И, Цай С.К., Хосла С. (2003). «Контроль длины цепи поликетида с помощью фактора длины цепи». Варенье. Chem. Soc. 125 (42): 12708–9. Дои:10.1021 / ja0378759. PMID 14558809.
- ^ Meurer G, Gerlitz M, Wendt-Pienkowski E, Vining LC, Rohr J, Hutchinson CR (1997). «Итерационные поликетидсинтазы, циклазы и кеторедуктазы типа II демонстрируют контекстно-зависимое поведение в биосинтезе линейных и угловых декаполикетидов». Chem. Биол. 4 (6): 433–43. Дои:10.1016 / S1074-5521 (97) 90195-2. PMID 9224566.
- ^ Wohlert SE, Wendt-Pienkowski E, Bao W, Hutchinson CR (2001). «Производство ароматических минимальных поликетидов генами даунорубицин поликетидсинтазы показывает несовместимость гетерологичных циклаз DpsY и JadI». J. Nat. Прод. 64 (8): 1077–80. Дои:10.1021 / np010067f. PMID 11520231.
- ^ Фецнер С (2002). «Оксигеназы без потребности в кофакторах или ионах металлов». Appl. Microbiol. Биотехнология. 60 (3): 243–57. Дои:10.1007 / s00253-002-1123-4. PMID 12436305.
- ^ а б Кендрю С.Г., Катаяма К., Дойч Э., Маддури К., Хатчинсон С.Р. (1999). «Циклаза DnrD, участвующая в биосинтезе доксорубицина: очистка и характеристика рекомбинантного фермента». Биохимия. 38 (15): 4794–9. Дои:10.1021 / bi9827924. PMID 10200167.
- ^ Ниеми Дж., Ван Й., Айрас К., Юлихонко К., Хакала Дж., Мянтсяля П. (1999). «Характеристика аклавинон-11-гидроксилазы из Streptomyces purpurascens». Биохим. Биофиз. Acta. 1430 (1): 57–64. Дои:10.1016 / S0167-4838 (98) 00265-9. PMID 10082933.
- ^ Оттен С.Л., Лю X, Фергюсон Дж., Хатчинсон CR (1995). «Клонирование и характеристика генов Streptomyces peucetius dnrQS, кодирующих фермент биосинтеза даунозамина и гликозилтрансферазу, участвующую в биосинтезе даунорубицина». J. Bacteriol. 177 (22): 6688–92. ЧВК 177529. PMID 7592454.
- ^ Янссон А., Ниеми Дж., Мянцяля П., Шнайдер Г. (2003). «Кристаллическая структура аклациномицинметилэстеразы со связанными аналогами продукта: значение для распознавания антрациклина и механизм». J. Biol. Chem. 278 (40): 39006–13. Дои:10.1074 / jbc.M304008200. PMID 12878604.
- ^ Янссон А., Коскиниеми Х., Мянцяля П., Ниеми Дж., Шнайдер Г. (2004). «Кристаллическая структура тройного комплекса DnrK, метилтрансферазы в биосинтезе даунорубицина, со связанными продуктами». J. Biol. Chem. 279 (39): 41149–56. Дои:10.1074 / jbc.M407081200. PMID 15273252.
